خطوات الحسابات الكيميائية
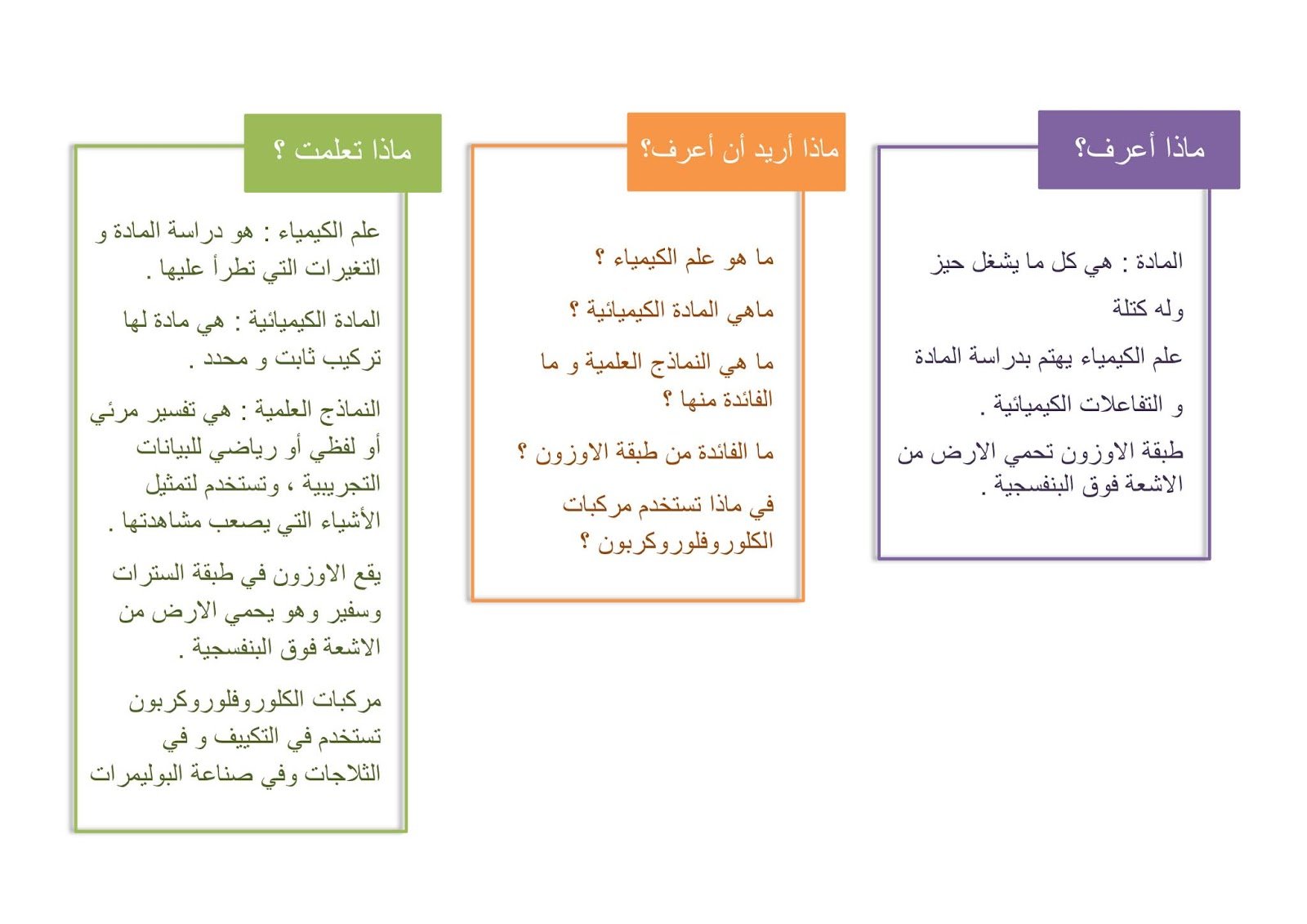
الحسابات الكيميائية من أساسيات الكيمياء، وهي مهمة لفهم التفاعلات الكيميائية وتحديد الكميات المتفاعلة والناتجة، وتعتمد الحسابات الكيميائية على قانون حفظ الكتلة والمول والنسبة المتكافئة، وإليك الخطوات الرئيسية للحسابات الكيميائية:
1. موازنة المعادلة الكيميائية
يجب أن تكون المعادلة الكيميائية متوازنة حتى يمكن إجراء الحسابات، أي أن يكون عدد ذرات كل عنصر متساوٍ على جانبي المعادلة، ويمكن موازنة المعادلة عن طريق إضافة معاملات تلائم المعادلة.

على سبيل المثال، معادلة تفاعل احتراق الميثان: CH4 + 2O2 → CO2 + 2H2O غير متوازنة، يمكن موازنتها عن طريق إضافة معامل 2 أمام CH4: 2CH4 + 2O2 → CO2 + 2H2O
الآن المعادلة متوازنة، ويمكن إجراء الحسابات عليها.


2. حساب المول

المول هو الوحدة الأساسية لكمية المادة، ويمثل عدد أفوجادرو من الجسيمات (6.022 × 1023)، ويمكن حساب عدد المولات من الكتلة باستخدام المعادلة:
عدد المولات = الكتلة (بالجرام) / الوزن الجزيئي أو الذري
على سبيل المثال، لحساب عدد المولات في 10 جرام من الميثان (CH4):

عدد المولات = 10 جرام / (12 جرام/مول + 4 جرام/مول) = 0.667 مول
3. استخدام النسبة المتكافئة

النسبة المتكافئة هي النسبة بين عدد المولات للمتفاعلات والناتجات وفقًا للمعادلة الكيميائية المتوازنة، ويمكن استخدام النسبة المتكافئة لحساب الكميات المتفاعلة والناتجة.
على سبيل المثال، وفقًا للمعادلة المتوازنة لتفاعل احتراق الميثان، فإن النسبة المتكافئة بين الميثان والأكسجين هي 2:2، أي أن كل مولين من الميثان يتفاعلان مع مولين من الأكسجين، وبالتالي لحساب كمية الأكسجين اللازمة لاحتراق 0.667 مول من الميثان:

كمية الأكسجين = 0.667 مول ميثان × (2 مول أكسجين / 2 مول ميثان) = 0.667 مول أكسجين

4. حساب الكتلة

يمكن حساب كتلة المتفاعلات أو النواتج باستخدام المعادلة:
الكتلة = عدد المولات × الوزن الجزيئي أو الذري

على سبيل المثال، لحساب كتلة ثاني أكسيد الكربون الناتج عن احتراق 0.667 مول من الميثان:
الكتلة = 0.667 مول CO2 × (12 جرام/مول + 32 جرام/مول) = 44 جرام CO2

5. حساب التركيز

يُقاس تركيز المحلول بوحدة المولار (مول/لتر)، ويمكن حسابه باستخدام المعادلة:

التركيز = عدد المولات / الحجم (باللتر)
على سبيل المثال، إذا تم إذابة 0.667 مول من الميثان في 10 لتر من الماء، فإن تركيز المحلول:

التركيز = 0.667 مول / 10 لتر = 0.0667 مولار

6. حساب الحجم

يمكن حساب حجم الغاز باستخدام قانون الغاز المثالي:

PV = nRT

حيث P هو الضغط، وV هو الحجم، وn هو عدد المولات، وR هو ثابت الغاز المثالي، وT هي درجة الحرارة.
على سبيل المثال، لحساب حجم 0.667 مول من الميثان عند درجة حرارة 25 درجة مئوية وضغط 1 ضغط جوي:

V = (0.667 مول × 0.0821 لتر.ضغط جوي / (مول.كلفن) × 298 كلفن) / 1 ضغط جوي = 15.5 لتر

7. التحليل الدوري

يمكن استخدام الحسابات الكيميائية للتحليل الدوري، مثل تحديد الوزن الذري والوزن الجزيئي، وحساب نسبة النظائر، وتحديد التكافؤ الكيميائي، واستخدام الحسابات الكيميائية في التحليل الدوري يساعد على فهم خصائص العناصر وتفاعلاتها.
استنتاج
الحسابات الكيميائية أداة أساسية لفهم التفاعلات الكيميائية وحساب الكميات المتفاعلة والناتجة، وتعتمد الحسابات الكيميائية على قانون حفظ الكتلة والمول والنسبة المتكافئة، وتشمل الخطوات الرئيسية للحسابات الكيميائية موازنة المعادلة الكيميائية، وحساب المول، واستخدام النسبة المتكافئة، وحساب الكتلة، وحساب التركيز، وحساب الحجم، والتحليل الدوري.
 السرداب ما لا يخطر على بال
السرداب ما لا يخطر على بال